lunes 29 de junio de 2015
http://www.abeille-du-saleve.org/?page_id=4057
https://www.facebook.com/CoronaApicultores

La réalisation d’un examen biométrique nécessite le prélèvement de 30 à 40 jeunes abeilles à l’intérieur de la ruche. Il faut les conserver vivantes et les mettre à la diète 48 heures avant de les tuer grâce à de l’acétate d’éthyle ou par asphyxie. Les échantillons doivent ensuite être placés dans de l’alcool à 60°.
Dans leur étude, Cornuet et al. utilisent des méthodes statistiques programmées (analyse discriminante et classification hiérarchique selon l’algorithme de Roux). Ils ont effectué de manière satisfaisante la discrimination et la classification de 8 races d’abeilles et de 3 hybrides interraciaux (métisses) à l’aide de 6 critères morphologiques.
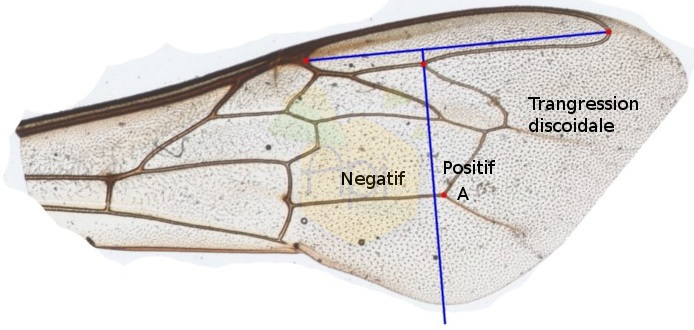
Si la droite perpendiculaire se trouve en position proximale de l’aile par rapport au point A : la transgression discoïdale est négative. Si la droite perpendiculaire se trouve en position distale de l’aile par rapport au point A : la transgression discoïdale est positive.
Ce caractère est particulièrement utile pour discriminer l’abeille noire mais il est diffcile à mesurer puisqu’il faut déterminer précisément les extrémités de la cellule radiale.
Le tableau ci-dessous présente une synthèse des résultats de biométrie de l’abeille. Les valeurs sont arrondies à 0,5 près.
Le logiciel Apiclass permet une analyse multi-point sur des ailes prises en photo avec un scanner à diapositive (Plustek). Ce logiciel utilise un système de mesure semi-automatique qui supprime l’effet opérateur. Les données ont été vérifiées à partir d’analyses morphométriques et moléculaires. Ce système est accessible en ligne et il nécessite d’utiliser une trentaine d’abeilles afin de déterminer l’appartenance d’une colonie à une race.
Les toiles suivantes sont une autre représentation des travaux de Frère Adam. La première toile compare les deux races majoritairement utilisées par les apiculteurs français.
On peut voir que par rapport à l’abeille Buckfast, l’abeille noire :
L’abeille Buckfast (Frère Adam) par rapport à l’abeille noire :
L’origine exclusivement maternelle du génome mitochondrial n’apporte donc pas d’informations sur le génotype des mâles dont sont issues les ouvrières. Cette étude ne permet qu’une détermination approximative de la race.
Le génome mitochondrial est caractérisé chez les abeilles par des régions intergéniques COI et COII dont la longueur varie d’une race à l’autre. Dans ces régions, il existe des sous unités P (54-67 pb, composées à 100 % d’adénine et de thymine) et des sous-unités Q (192-196 pb, composées à 93,4 % d’adénine et de thymine. Ces sous-unités peuvent présenter différentes combinaisons : P, PQ, PQQ … Afin d’étudier les régions intergéniques, il faut les amplifier par PCR, à l’aide des primers suivants :

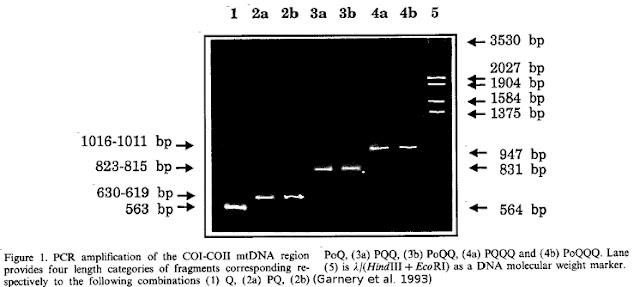
Les fragments sont ensuite migrés par électrophorèse. La figure suivante nous indique les tailles identifiables sur le gel d’électrophorèse. Les échantillons contenant :
Afin de discriminer précisément les sous-unités intergéniques P et Po, les fragments d’ADN doivent être digérés par l’enzyme de restriction Dra1. Après digestion, une électrophorèse est réalisée à l’aide d’un gel de polyacrylamide entre 5 et 10 %. Les haplotypes A et M sont définis suivant ces profils de restriction. Il est aussi possible de séquencer la partie amplifiée afin de discriminer les fragments P et Po.

Le génome nucléaire est transmis à la descendance par la mère et le père, dans le cas des ouvrières, et uniquement par la mère dans le cas des faux-bourdons (voirGénétique et vie en société chez les Hyménoptères (Apis mellifera)). L’étude du génome nucléaire, de 50 ouvrières au moins, permet de déterminer le génotype des mâles fécondant la reine et donc l’introgression.
L’ADN nucléaire présente de faibles variations entre les individus ; seules les régions très variables du génome sont utilisées : on parle de marqueur. Les marqueurs les plus utilisés chez les abeilles sont les microsatellites. Ils correspondent à des zones du génome (loci) constituées de centaines de répétitions en tandem de quelques paires de base (1-5 pb). Pour un même locus, on retrouve un nombre variable de répétitions suivant les sous espèces (allèles).
A partir de l’étude de plusieurs loci, des arbres ont été réalisés par la méthode phénétique de « neighbor joining », qui permet de quantifier la ressemblance entre individus. Pour cela, on calcule un indice de similitude globale et donc des distances génétiques pour chaque couple d’individus. On construit l’arbre par regroupement successif des individus les plus similaires par rapport aux plus différents.
Comme l’ADN est un « langage quaternaire » (ACTG), cette technique pose le problème que deux séquences similaires peuvent être soit très proches, soit très éloignées car issues de nombreuses mutations. Pour limiter le biais lié à cette méthode, les échantillons ne sont donc pas regroupés en fonction de leur ressemblance mais en fonction d’un algorithme qui minimise la longueur totale de l’arbre. Avec l’augmentation des puissances de calcul des ordinateurs, la méthode phénétique est obsolète et des méthodes probabilistes sont utilisées (aucune publication n’est encore parue).
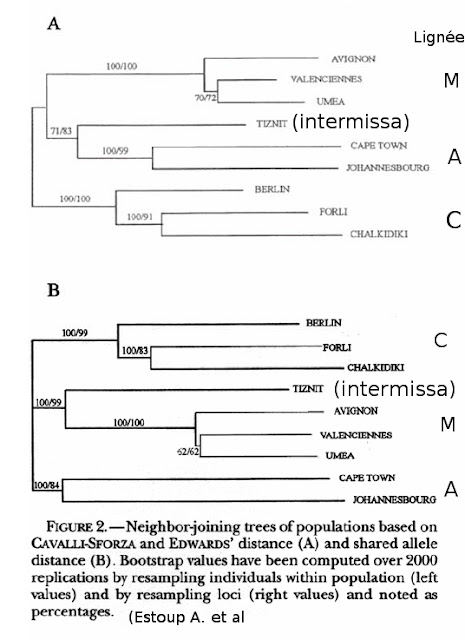
Grâce à la méthode phénétique, les arbres obtenus sont similaires à ceux des méthodes morphométriques et mitochondriales, sauf pour la race intermissa qui se situe dans la lignée M suivant l’algorithme utilisé.
Les données moléculaires amènent à penser que la radiation de ces lignées a eu lieu au Pléistocène. Au Pléistocène, les aires de répartition des lignées M et C-O sont séparées par une calotte glaciaire. Ceci peut expliquer la première divergence apparue entre les lignées M et C-O. La divergence entre les lignées C et O est plus tardive car l’isolation de ces deux lignées a été plus faible au cours du temps.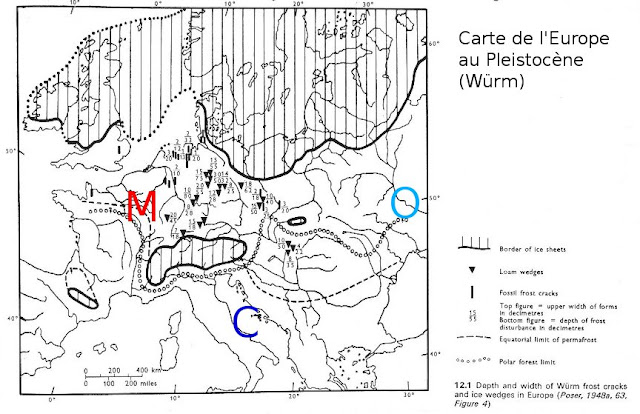 Toutes ces races peuvent se reproduire entre elles. Le réchauffement de l’Europe et la fonte des calottes glaciaires a conduit à un brassage : les populations d’A. mellifera présentent de nombreux individus métisses M/C issus des importations de reines de la lignée C durant les 40 dernières années.
Toutes ces races peuvent se reproduire entre elles. Le réchauffement de l’Europe et la fonte des calottes glaciaires a conduit à un brassage : les populations d’A. mellifera présentent de nombreux individus métisses M/C issus des importations de reines de la lignée C durant les 40 dernières années.
Les races Iberica, Lingustica et Sicula ont des origines métisses plus anciennes résultant de l’introgression secondaire des rameaux A-M (en Espagne), M-C (pays de l’est) et C-A (en France). Le métissage peut atteindre des niveaux extrêmes puisqu’une population du Portugal est uniquement constituée d’un haplotype A, alors que les individus analysés possèdent un génome nucléaire M apparemment pur.
Ces différences peuvent être liées à la diversité des comportements entre sexes et entre races, à l’influence de l’homme et à d’éventuelles contraintes sélectives appliquées sur les molécules étudiées.
Il existe un centre de dispersion situé au nord du Golf Persique à partir duquel les abeilles ont colonisé l’Europe. La glaciation Pléistocène a conduit à l’isolation de population et à la mise en place de races. Après la fonte des glaces, les différentes races se sont alors métissées : la conservation et l’élevage de races pures agit à l’encontre de la nature actuellement.
Cependant, la conservation de races pures permet de bénéficier de l’effet d’hétérosis (individu hétérozygote) par simple croisement. L’élevage en race n’entraine pas forcement une meilleure conservation de la biodiversité génétique par rapport aux croisements qui sont des réarrangements de gènes préexistants.
L’élevage en race pure favorise la biodiversité s’il permet la conservation des certains allèles dans un contexte donné (exemple : caractère d’essaimage, agressivité, tenue au cadre). Il s’agit dans ce cas de créer une « banque d’allèles rares » qui seront peut être nécessaires dans le futur.
http://www.abeille-du-saleve.org/?page_id=4057
https://www.facebook.com/CoronaApicultores
Les critères de différenciation des races d’abeilles
La biométrie
Le terme « biométrie » signifie « mesure du vivant » et désigne au sens large l’étude quantitative des êtres vivants. Cet article s’appuie sur les travaux de Cornuet et al. qui sont une synthèse des données de biométrie chez l’abeille.La réalisation d’un examen biométrique nécessite le prélèvement de 30 à 40 jeunes abeilles à l’intérieur de la ruche. Il faut les conserver vivantes et les mettre à la diète 48 heures avant de les tuer grâce à de l’acétate d’éthyle ou par asphyxie. Les échantillons doivent ensuite être placés dans de l’alcool à 60°.
Dans leur étude, Cornuet et al. utilisent des méthodes statistiques programmées (analyse discriminante et classification hiérarchique selon l’algorithme de Roux). Ils ont effectué de manière satisfaisante la discrimination et la classification de 8 races d’abeilles et de 3 hybrides interraciaux (métisses) à l’aide de 6 critères morphologiques.
La coloration de l’abdomen
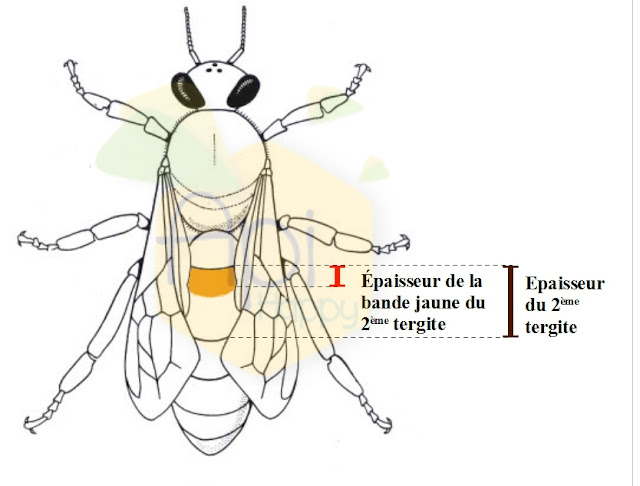
La coloration de l’abdomen est mesurée au niveau du 2ème tergite abdominal (grossissement x 10) et plus précisément la largeur des tâches ou de la bande jaune présentes sur ce tergite. La largeur obtenue doit être comprise entre 0,01 et 2,40 mm.
La pilosité abdominale
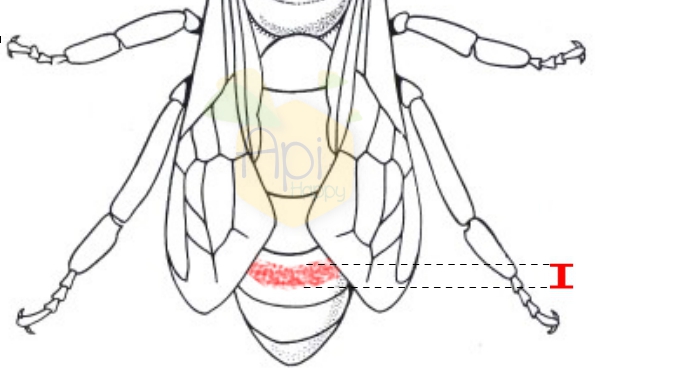
La longeur des poils de l’abdomen est mesurée au niveau du 5ème tergite abdominal à l’aide d’un réticule oculaire à 120 divisions (grossissement x 40).
La largeur du tomentum
Le tomentum correspond à la bande pileuse abdominale. Elle est mesurée sur le 4ème tergite abdominal (grossissement x 10).
La longueur de la langue
La longueur de la langue (probocis) est mesurée après avoir coupé et retourné la tête de l’abeille (grossissement x 10). La glosse (partie des pièces buccales de l’abeille) est mise en extension à l’aide de pinces à dissection.L’index cubital
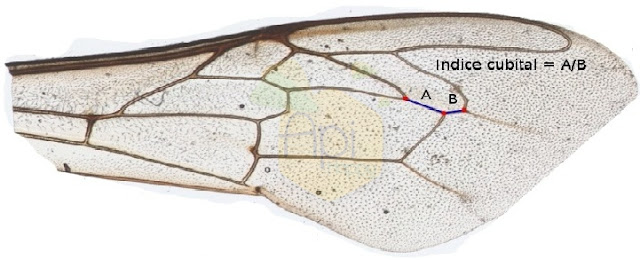
L’index cubital est mesuré au niveau des nervures de l’aile antérieure d’une ouvrière. Les nervures délimitent des cellules. Sur la 3ème cellule cubitale, la longueur des nervures A et B est mesurée. L’indice cubital correspond au rapport A/B.
La transgression discoïdale
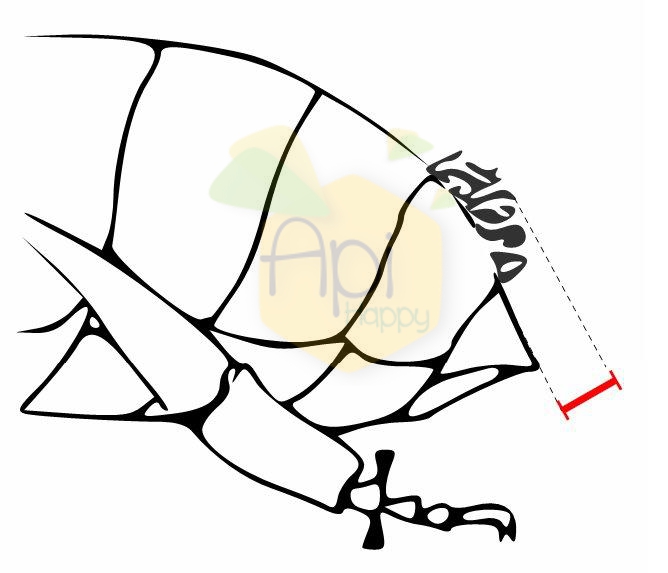
La transgression discoïdale est mesurée au niveau des nervures de l’aile antérieure d’une ouvrière. Pour déterminer la position du point discoïdal (A) il faut tracer une droite reliant les deux extrémités de la cellule radiale (CR) puis tracer une droite perpendidulaire passant par l’intersection des nervures de la cellule radiale et cubitale.Si la droite perpendiculaire se trouve en position proximale de l’aile par rapport au point A : la transgression discoïdale est négative. Si la droite perpendiculaire se trouve en position distale de l’aile par rapport au point A : la transgression discoïdale est positive.
Ce caractère est particulièrement utile pour discriminer l’abeille noire mais il est diffcile à mesurer puisqu’il faut déterminer précisément les extrémités de la cellule radiale.

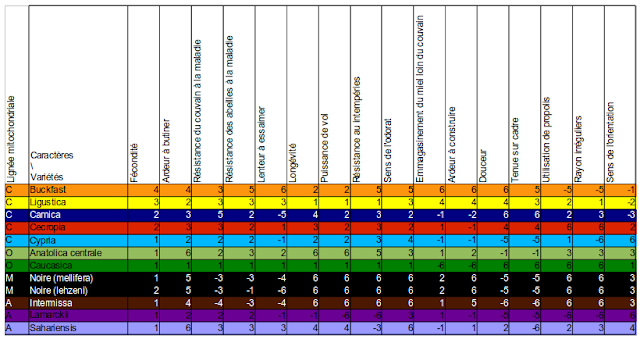
Synthèse des données de biométrie
Ruttner détermine en 1988 que les races d’abeilles peuvent être classées en 4 lignées évolutives principales :- la lignée M à l’ouest de l’Europe : de l’Espagne à la Scandinavie (Abeille noire) ;
- la lignée C au centre et au nord de l’Europe ;
- la lignée A en Afrique ;
- la lignée O en Turquie et dans le Caucase.

Le tableau ci-dessous présente une synthèse des résultats de biométrie de l’abeille. Les valeurs sont arrondies à 0,5 près.
| Lignée | Race | Moyenne et valeurs extrêmes | Couleur (mm) | Pilosité (mm) | Tomentum (mm) | Langue (mm) | Indice cubital | Transgression discoïdale |
| C (maternelle) | Buckfast | Moyenne | Proche Lingustica | Proche Lingustica | Proche Lingustica | Proche Lingustica | Proche Lingustica | Positive |
| C | Lingustica | Moyenne | 1,75 | 0,3 | 0,85 | 6,5 | 2,3 | Positive |
| Valeurs extrêmes | 1,4 – 2,2 | 0,2 – 0,4 | 0,8 – 1 | 6,3 – 6,6 | 2 – 2,7 | |||
| Carnica | Moyenne | 0,35 | 0,6 | 0,9 | 6,6 | 2,6 | Positive | |
| Valeurs extrêmes | 0,2 – 0,6 | 0,2 – 0,4 | 0,8 – 1 | 6,4 – 6,8 | 2,3 – 3,2 | |||
| Cecropia | Moyenne | |||||||
| Cypria | Moyenne | Jaune | 6,38 | 2,72 ±0,3 | ||||
| O | Anatolica | Moyenne | 2,25 ± 0,2 | |||||
| Caucasica | Moyenne | 0,3 | 0,3 | 1 | 7 | 2 | Nulle | |
| Valeurs extrêmes | 0,2 – 0,4 | 0,25 – 0,4 | 0,8 – 1,2 | 6,7 – 7,2 | 1,7 – 2,3 | |||
| M | Mellifera (abeille noire) | Moyenne | 0,25 | 0,45 | 0,75 | 6,3 | 1,75 | Négative |
| Valeurs extrêmes | 0 – 0,3 | 0,4 – 0,52 | 0,6 – 0,8 | 6 – 6,5 | 1,4 – 2,1 | |||
| A | Intermissa | Moyenne | 0,2 | 0,2 | 0,6 | 6,4 | 2,2 | |
| Valeurs extrêmes | 0,1 – 0,4 | 0,15 – 0,35 | 0,5 – 0,7 | 6,3 – 6,6 | 2,1 – 2,3 | |||
| Lamarckii | Moyenne | 1,53 | 0,18 | 0,97 | 5,82 | 2,26 | ||
| Sahariensis | Moyenne | 1,53 | 0,2 | 0,53 | 5,91 | 2,71 | ||
| Adansonii | Moyenne | 1,52 | 0,13 | 0,37 | 5,58 | 2,2 | ||
| Syriava | Moyenne | 1,59 | 0,16 | 0,83 | 6,44 | 2,44 | ||
| Meda | 2,5 ± 0,2 |
Le logiciel Apiclass permet une analyse multi-point sur des ailes prises en photo avec un scanner à diapositive (Plustek). Ce logiciel utilise un système de mesure semi-automatique qui supprime l’effet opérateur. Les données ont été vérifiées à partir d’analyses morphométriques et moléculaires. Ce système est accessible en ligne et il nécessite d’utiliser une trentaine d’abeilles afin de déterminer l’appartenance d’une colonie à une race.
Ce système semble peu fiable (une mère à 98 % noire donne des filles Intermissa ; la même photo passée plusieurs fois au scanner donne différents résultats) : les caractéristiques des hybrides(métisses) ne sont pas enregistrées dans le logiciel.
L’éthologie
La biométrie est un outil d’identification des races d’abeilles. Frère Adam travaillait sur l’éthologie de chaque race, c’est-à-dire leur comportement. Le tableau ci-dessous présente une synthèse de ses études.
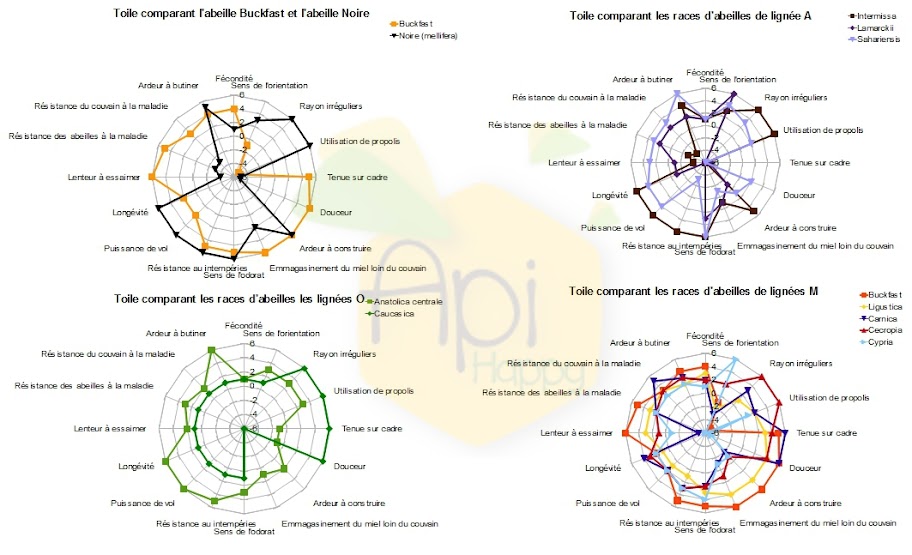
Les toiles suivantes sont une autre représentation des travaux de Frère Adam. La première toile compare les deux races majoritairement utilisées par les apiculteurs français.

On peut voir que par rapport à l’abeille Buckfast, l’abeille noire :
- a un meilleur sens de l’orientation ;
- construit des rayons plus irréguliers ;
- utilise plus de propolis ;
- résiste un peu mieux aux intempéries ;
- a un odorat légèrement plus développé ;
- a une puissance de vol plus importante ;
- a une longévité plus élevée.
L’abeille Buckfast (Frère Adam) par rapport à l’abeille noire :
- a une meilleure résistance aux maladies ;
- a une tendance plus importante à essaimer ;
- a une fécondité plus élevée ;
- emmagasine le miel loin du couvain ce qui ne bloque pas la ponte ;
- est plus douce ;
- a une tenue au cadre plus élevée.
L’étude moléculaire
L’étude du génome mitochondrial
Chez les abeilles, l’information génétique est contenue sous forme d’ADN dans le noyau et dans certains organites comme les mitochondries. Les mitochondries sont exclusivement et entièrement héritées de la mère. L’étude du génome mitochondrial d’une seule ouvrière nous renseigne donc sur le génotype de la reine.L’origine exclusivement maternelle du génome mitochondrial n’apporte donc pas d’informations sur le génotype des mâles dont sont issues les ouvrières. Cette étude ne permet qu’une détermination approximative de la race.
La détermination d’une lignée à partir du génome mitochondrial
Le génome mitochondrial permet de discrimier des lignées. Une lignée correspond à une race ou un ensemble de races ayant une histoire évolutive commune.Le génome mitochondrial est caractérisé chez les abeilles par des régions intergéniques COI et COII dont la longueur varie d’une race à l’autre. Dans ces régions, il existe des sous unités P (54-67 pb, composées à 100 % d’adénine et de thymine) et des sous-unités Q (192-196 pb, composées à 93,4 % d’adénine et de thymine. Ces sous-unités peuvent présenter différentes combinaisons : P, PQ, PQQ … Afin d’étudier les régions intergéniques, il faut les amplifier par PCR, à l’aide des primers suivants :

Les fragments sont ensuite migrés par électrophorèse. La figure suivante nous indique les tailles identifiables sur le gel d’électrophorèse. Les échantillons contenant :
- les sous-unités intergéniques P sont de lignée M ;
- les sous-unités intergéniques Po sont de lignée A ;
- ni les sous-unités intergéniques P et ni les sous-unités intergéniques Po sont de lignée C.

Afin de discriminer précisément les sous-unités intergéniques P et Po, les fragments d’ADN doivent être digérés par l’enzyme de restriction Dra1. Après digestion, une électrophorèse est réalisée à l’aide d’un gel de polyacrylamide entre 5 et 10 %. Les haplotypes A et M sont définis suivant ces profils de restriction. Il est aussi possible de séquencer la partie amplifiée afin de discriminer les fragments P et Po.

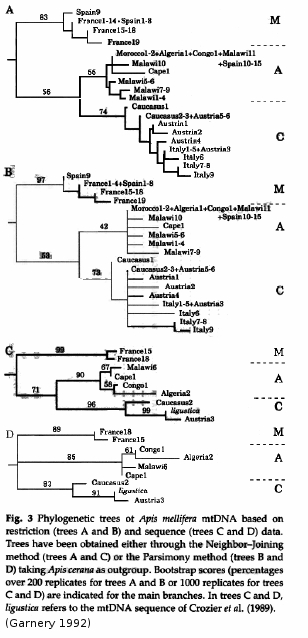
Les données apportées par l’étude du génome mitochondrial
Les données acquises à partir de l’étude du génome mitocondrial sont utilisées dans différentes méthodes de classification et ont permis la construction d’arbres de classification similaires. Cet arbre est donc robuste : on remarque dans chaque cas que les lignées A et C sont plus apparentées entre elles qu’avec la lignée M.
L’étude du génome nucléaire

Le génome nucléaire est transmis à la descendance par la mère et le père, dans le cas des ouvrières, et uniquement par la mère dans le cas des faux-bourdons (voirGénétique et vie en société chez les Hyménoptères (Apis mellifera)). L’étude du génome nucléaire, de 50 ouvrières au moins, permet de déterminer le génotype des mâles fécondant la reine et donc l’introgression.
L’ADN nucléaire présente de faibles variations entre les individus ; seules les régions très variables du génome sont utilisées : on parle de marqueur. Les marqueurs les plus utilisés chez les abeilles sont les microsatellites. Ils correspondent à des zones du génome (loci) constituées de centaines de répétitions en tandem de quelques paires de base (1-5 pb). Pour un même locus, on retrouve un nombre variable de répétitions suivant les sous espèces (allèles).
A partir de l’étude de plusieurs loci, des arbres ont été réalisés par la méthode phénétique de « neighbor joining », qui permet de quantifier la ressemblance entre individus. Pour cela, on calcule un indice de similitude globale et donc des distances génétiques pour chaque couple d’individus. On construit l’arbre par regroupement successif des individus les plus similaires par rapport aux plus différents.
Comme l’ADN est un « langage quaternaire » (ACTG), cette technique pose le problème que deux séquences similaires peuvent être soit très proches, soit très éloignées car issues de nombreuses mutations. Pour limiter le biais lié à cette méthode, les échantillons ne sont donc pas regroupés en fonction de leur ressemblance mais en fonction d’un algorithme qui minimise la longueur totale de l’arbre. Avec l’augmentation des puissances de calcul des ordinateurs, la méthode phénétique est obsolète et des méthodes probabilistes sont utilisées (aucune publication n’est encore parue).
Grâce à la méthode phénétique, les arbres obtenus sont similaires à ceux des méthodes morphométriques et mitochondriales, sauf pour la race intermissa qui se situe dans la lignée M suivant l’algorithme utilisé.
Comprendre la biogéographie d’Apis mellifera
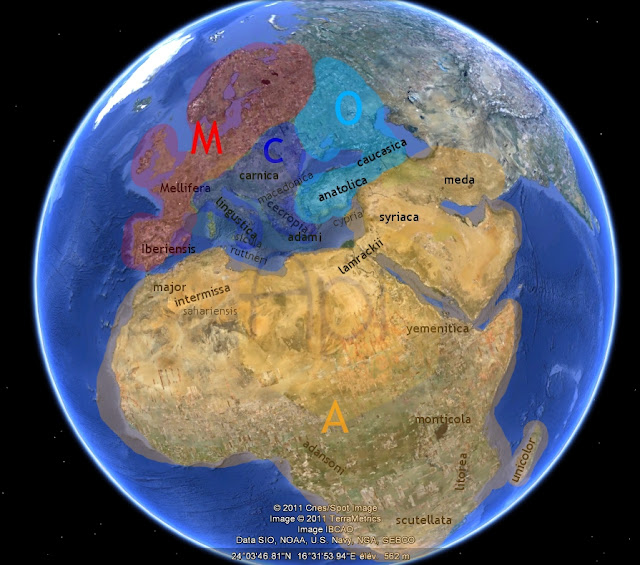
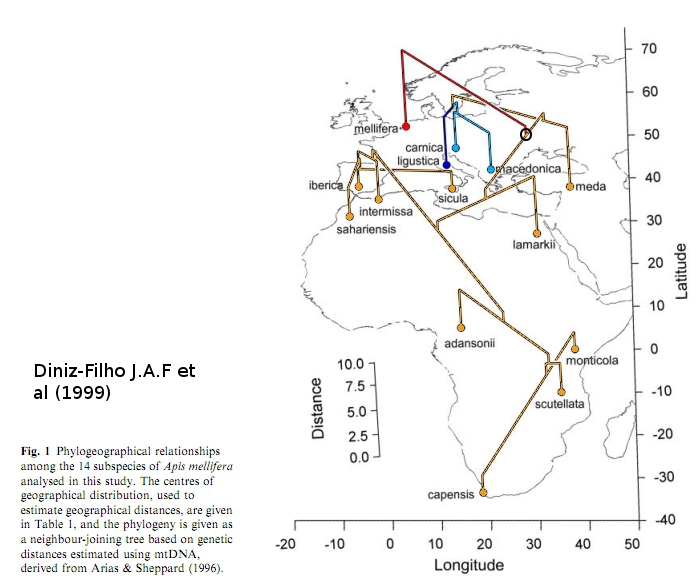
Le travail de l’équipe Diniz-Filho J.A.F a consisté à mettre en relation des données moléculaires et morphologiques afin de comprendre la biogéographie de l’abeille. Leur travail est présenté dans le document suivant. Le centre dispersion des lignées d’abeilles se situe au Moyen Orient. On remarque que :- la lignée A a colonisé l’Afrique ;
- la lignée M a colonisé l’Europe de l’Ouest ;
- les lignées C et O sont plus apparentées entre elles : la lignée C a colonisé les territoires au sud des Alpes en passant par la Turquie, alors que la lignée O a colonisé l’est de l’Europe en passant par le Caucase.

Les données moléculaires amènent à penser que la radiation de ces lignées a eu lieu au Pléistocène. Au Pléistocène, les aires de répartition des lignées M et C-O sont séparées par une calotte glaciaire. Ceci peut expliquer la première divergence apparue entre les lignées M et C-O. La divergence entre les lignées C et O est plus tardive car l’isolation de ces deux lignées a été plus faible au cours du temps.
Les races Iberica, Lingustica et Sicula ont des origines métisses plus anciennes résultant de l’introgression secondaire des rameaux A-M (en Espagne), M-C (pays de l’est) et C-A (en France). Le métissage peut atteindre des niveaux extrêmes puisqu’une population du Portugal est uniquement constituée d’un haplotype A, alors que les individus analysés possèdent un génome nucléaire M apparemment pur.
Ces différences peuvent être liées à la diversité des comportements entre sexes et entre races, à l’influence de l’homme et à d’éventuelles contraintes sélectives appliquées sur les molécules étudiées.
Conclusion sur les races d’abeilles
Les différentes race d’abeilles sont déterminées grâce à leur biométrie (couleurs, index…) mais aussi grâce à des marqueurs moléculaires (mitochondrial et nucléaire). Définir des races nous permet de comprendre la biogéographie de l’abeille.Il existe un centre de dispersion situé au nord du Golf Persique à partir duquel les abeilles ont colonisé l’Europe. La glaciation Pléistocène a conduit à l’isolation de population et à la mise en place de races. Après la fonte des glaces, les différentes races se sont alors métissées : la conservation et l’élevage de races pures agit à l’encontre de la nature actuellement.
Cependant, la conservation de races pures permet de bénéficier de l’effet d’hétérosis (individu hétérozygote) par simple croisement. L’élevage en race n’entraine pas forcement une meilleure conservation de la biodiversité génétique par rapport aux croisements qui sont des réarrangements de gènes préexistants.
L’élevage en race pure favorise la biodiversité s’il permet la conservation des certains allèles dans un contexte donné (exemple : caractère d’essaimage, agressivité, tenue au cadre). Il s’agit dans ce cas de créer une « banque d’allèles rares » qui seront peut être nécessaires dans le futur.
No hay comentarios:
Publicar un comentario